生物制剂尤其是重组单克隆抗体、细胞因子等在肿瘤、自身免疫性疾病等治疗领域中展现出其他药物无法替代的突出临床疗效。然而随着大批原研生物药将在2020年专利到期,以原研生物药质量、安全性和有效性为基础的生物类似物的研发迎来重要发展机遇,越来越多的生物类类似药也将批准上市,本文就生物类类似药的关键和热点问题进行探讨。
(一)生物类似药的概念
WHO、美国FDA、欧盟EMA以及我国CFDA对于生物类似药都进行了定义,其内容大致相同,具体见图1。

图1生物类似药的概念
化学制剂的仿制药可以做到百分之百的复制,但是生物类似药无法做到百分百复制原研药。这与生物药本质的大分子性和结构复杂性以及生物药生产工艺的复杂性相关,见图2。从DNA载体或细胞株的选择到细胞培养条件,从产品的纯化、生产到包装、运输、储存等各个环节中任何微小差别都有可能对生物类似药有效性和安全性产生巨大影响。
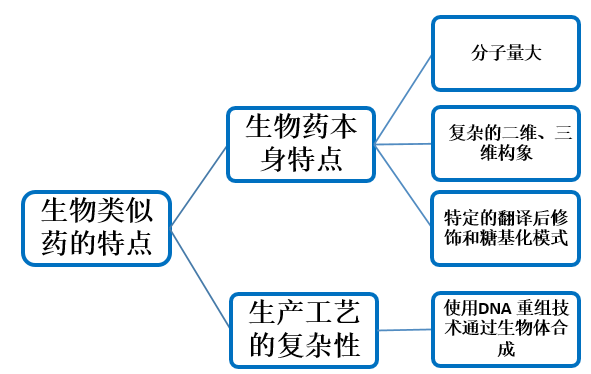
图2 生物类似药的特点
虽然很难与原研药完全相同,但其相比于生物原研药具有成本低的优势,不仅可以减轻政府医疗保险的负担,也减轻患者经济负担,增加了生物制品的可及性。为了让患者可以及时获得这些生物制品,需要建立明确的生物类似药上市审批途径。生物类似药研发过程包括分析研究(分子表征以及蛋白质结构和功能),临床前研究(动物体内PK/PD,免疫原性以及药物毒性试验),临床药理性研究(人体内PK/PD,免疫原性以及药物毒性试验)和比较性临床研究(剂量范围,疗效和安全性试验)[1],见图3。
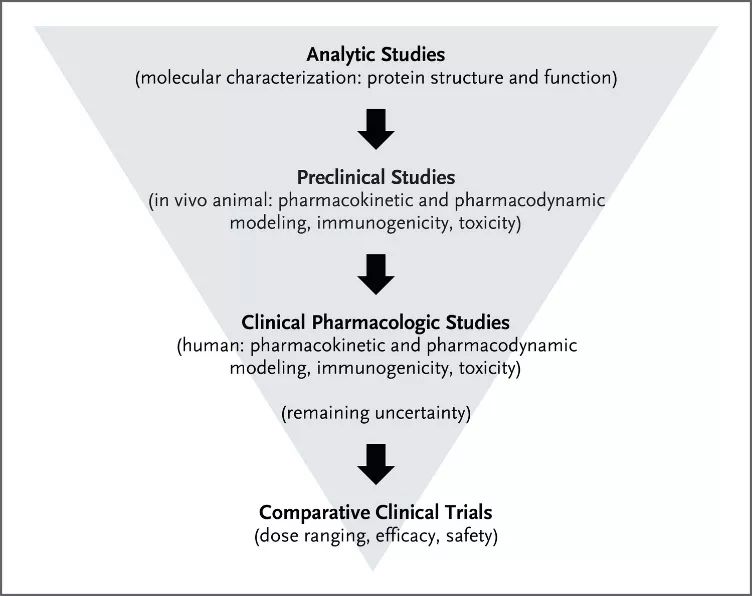
图3 生物类似药研发审批过程
任何生物类似药入临床应用前都要进行证明生物类似药与原研药在结构及功能、药代动力学、药效动力学、安全性和有效性相似的临床前及临床研究。与生物原研药的审批着重于临床研究不同,生物类似药的审批侧重于分析研究和临床前研究。生物类似药与生物原研药在临床研究要求上也存在差异。生物原研药研究人群无特殊要求,研究终点为临床结局数据或可接受的/已建立的替代终点(如OS、PFS);而生物类似药研究人群要求敏感和一致性人群,研究终点为敏感研究终点(如ORR)。
生物类似药仅需Ⅰ期及Ⅲ期临床试验,并且Ⅲ期临床试验推荐以ORR作为首要终点[2]。目前以ORR为主要研究终点是否能充分反映生物类似药的长期疗效尚存争议。一项meta分析[3]共纳入25项非小细胞肺癌随机对照临床研究,提示OS的HR与6个月的ORR率之间没有相关性(R2 = 0.05;95% CI,0.0001-0.31),与9个月的PFS率之间也没有相关性(R2 = 0.19;95% CI,0.03-0.49)。另外,临床研究中免疫原性、不良反应的安全性监测也很重要。
生物类似药的一系列研发过程证明生物类似药与原研生物药具有生物相似性,但两者之间互换使用仍存在许多潜在风险,见图4。生物类似药的可互换性比生物相似性具有更高的要求。为了将生物类似药标记为可互换,必须在原研生物药和生物类似药之间进行交替换药研究,除非该类似药只在给定患者中使用一次[4]。一项研究[5]表明在生物制品及其类似物之间互换的安全性方面存在着证据空白,需要交替换药研究来支持生物类似药转换的决策。目前尚没有一种生物类似药被FDA批准能与原研生物药互换使用。因此,关于原研生物药和生物类似药是否互换需谨慎选择。
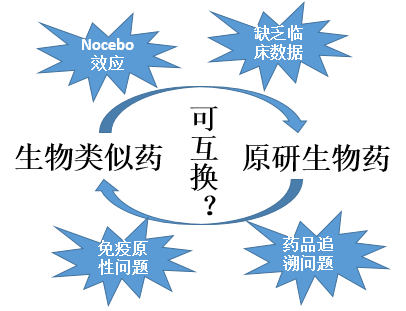
图4 原研生物药和生物类似药互换的潜在风险
抗肿瘤药物是生物类似药研发的重点领域。2017年9月14日Mvasi(bevacizumab-awwb)成为美国FDA批准的第一个贝伐珠单抗生物类似物,也是第一个治疗肿瘤的生物类似物。之后陆续有利妥昔单抗生物类似物、曲妥珠单抗生物类似物、阿达木单抗生物类似物获FDA批准。今年2月,汉利康®(产品代号:HLX01)成为国内获批的首个生物类似药,填补了国产利妥昔单抗的空白。国内外CD20单抗类似药、EGFR单抗类似药、VEGF单抗类似药、HER2单抗类似药、TNF单抗类似药均有多种产品进入临床Ⅲ期阶段。未来将不断丰富生物类似药的研究数据,生物类似药也将抗肿瘤治疗方面发挥重大作用。
综上所述,虽然生物类似药无法做到百分百复制原研药,但其研发上市进行严格的临床前研究和临床研究可以证明生物类似药与原研生物药具有生物相似性。目前针对生物类似药以ORR为临床研究终点是否能代表长期疗效以及原研生物药和生物类似药是否互换仍存在争议,需要更多临床证据。目前多个生物类似药已经获批,各类生物类似药的多种产品也已近进入临床Ⅲ期阶段,未来生物类似药将在肿瘤领域发挥巨大作用。
医学博士,副主任医师,副教授,博士生导师
同济大学附属上海市肺科医院肿瘤科行政副主任
中国医疗保健国际交流促进会胸部肿瘤分会常委/秘书长
国际肺癌联合会(IASLC)事业发展委员会委员
中国临床肿瘤协会(CSCO)非小细胞肺癌专业委员会常务委员
中国临床肿瘤协会(CSCO)青年委员会常务委员
中国临床肿瘤协会(CSCO)免疫委员会委员
中国老年协会肿瘤专业委员会常务委员
上海市抗癌协会肿瘤呼吸内镜学专业委员会常务委员
宋庆龄基金会肿瘤产学研联盟疑难肿瘤专业委员会委员
主要研究方向为肺癌精准治疗,肺癌早期诊断、综合治疗、靶向治疗与个体化诊疗,长期从事肺癌的早期诊断和肺癌精准化治疗相关的临床和转化研究。获得 上海市卫生系统“银蛇奖“,“IASLC fellowship award”、“上海曙光计划”、“上海市人才发展基金” “上海市卫计委优秀青年人才”等多项人才项目资助。主持国家自然科学基金面上项目、上海市科委引导项目等课题8项。近5年作为主要参与人,先后获得包括上海市科技进步一等奖在内的省部级等一等奖4项。已发表SCI论文100余篇,其中近5年发表第一作者或通讯作者SCI论文近30篇,累计影响因子达170分以上,累计引用次数达300次以上。近5年国际大会WCLC,ESMO-Asia等发言20余次。
?





 京公网安备 11010502033352号
京公网安备 11010502033352号